甲醛
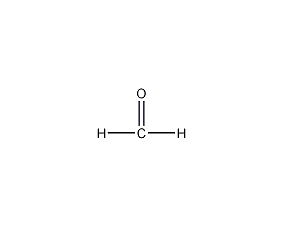
结构式
| 物竞编号 | 0131 |
|---|---|
| 分子式 | CH2O |
| 分子量 | 30.03 |
| 标签 |
福尔马林, 蚁醛, 亚甲基氧化物, Methyl aldehyd, Methylene oxide, Formalin, Formicaldehyde, Methanal solution, Oxymethylene, Dormol, 农药中间体, 脂肪族醛、酮及其衍生物, 有机化合物 |
编号系统
CAS号:50-00-0
MDL号:MFCD00003274
EINECS号:200-001-8
RTECS号:LP8925000
BRN号:1209228
PubChem号:24894976
物性数据
1.性状:一种无色,有强烈刺激性和窒息性气味的气体。
2.蒸汽相对密度(g/mL,空气=1):1.081-1.085
3.相对密度(g/mL,水=1):0.82
4.折射率(nD20):1.3755-1.3775
5.闪点(℃):56(气体);83(37%水溶液,闭杯)
6.沸点(℃):-19.5(气体);98 (37%水溶液)
7.熔点(℃):-92
8.自燃温度 (℃):430
9.蒸汽压(KPa,-57.3℃) :13.33
10.爆炸极限(V/V):空气中7%~73%
11.油水(辛醇/水)分配系数的对数值(logP):0.35
12.临界温度(ºC):137.2~141.2
13.临界压力(MPa):6.784~6.637
14.黏度(mPa·s,-20ºC):0.242
15.爆炸下限(%,V/V):7.0
16.爆炸上限(%,V/V):73
17.溶解性:易溶于水和。水溶液浓度高可达55%。能与水、、丙酮任意混溶。在空气中能逐渐被氧化为甲酸,是强还原剂。其蒸气与空气形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。在一般商品中,都加入10%~12%的甲醇作为抑制剂,否则会发生聚合。
18.气相标准燃烧热(焓)(kJ·mol-1):-570.77
19.气相标准声称热(焓)( kJ·mol-1) :-108.57
20.气相标准熵(J·mol-1·K-1) :218.76
21.气相标准生成自由能( kJ·mol-1):-102.5
22.气相标准热熔(J·mol-1·K-1):35.39
毒理学数据
1、急性毒性:LD50800mg/kg(大鼠经口),2700mg/kg(兔经皮);LC50590mg/m3(大鼠吸入);
人吸入60~120mg/m3,发生支气管炎、肺部严重损害;
人吸入12~24mg/m3,鼻、咽粘膜严重灼务、流泪、咳嗽;人经口10~20ml,致死。
2、 亚急性和慢性毒性:大鼠吸入50~70mg/m3,1小时/天,3天/周,35周,发现气管及支气管基底细胞增生及生化改变;
人吸入20~70mg/m3长时间,食欲丧失、体重减轻、无力、头痛、失眠;
人吸入12mg/m3长期接触,嗜睡、无力、头痛、手指震颤、视力减退。
3、 致突变性:微生物致突变:鼠伤寒沙门氏菌4mg/L。哺乳动物体细胞突变:人淋巴细胞130umol/L。姊妹染色体交换:人淋巴细胞37pph。
4、 生殖毒性:大鼠经口低中毒剂量(TDL0):200mg/kg(1天,雄性),对精子生存有影响。大鼠吸入低中毒浓度(TCL0):12ug/m3,24小时(孕1~22天),引起新生鼠生化和代谢改变。
5、致癌性:IARC致癌性评论:动物阳性;人类不明确。
6、甲醛对眼睛、呼吸道及皮肤有强烈刺激性。接触甲醛蒸气引起结膜炎、角膜炎、鼻炎、支气管炎等。重点发生喉痉挛、声门水肿、肺炎、肺水肿。对皮肤有原发性刺激和致敏作用。可致皮炎。浓溶液可引起皮肤凝固性坏死。口服灼伤口腔和消化道,可发生胃肠道穿孔、休克和肝肾损害。长期接触低浓度甲醛可有轻度眼及上呼吸道刺激症状、皮肤干燥、皲裂。工作场所空气中有毒物质高容许浓度为0.5mg/m3。
生态学数据
1、代谢和降解:环境中甲醛的主要污染来源是有机合成、化工、合成纤维、染料、木材加工及制漆等行业排放的废水、废气等。某些有机化合物在环境中降解也产生甲醛,如氯乙烯的降解产物也包含甲醛。由于甲醛有强的还原性,在有氧化性物质存在条件下,能被氧化为甲酸。例如进入水体环境中的甲醛可被腐生菌氧化分解,因而能消耗水中的溶解氧。甲酸进一步的分解产物为二氧化碳和水。进入环境中的甲醛在物理、化学和生物等的共同作用下,被逐渐稀释氧化和降解。甲醛的氧化降解过程如下:2HCHO+O2---2HCOOH 2HCOOH+O2---2H2O+2CO2
2、残留与蓄积:资料记载,工业企业区土壤中吸附的甲醛含量可达180-720mg/kg干土。土壤的污染可导致地下水污染,水中甲醛含量可以比表层土高出10-20倍。
甲醛在环境中颇稳定,当水中甲醛浓度为5mg/L时(20℃),观察结果表明,5天内可以保持恒定。水中甲醛浓度为<20mg/L时,可以被曝气池中经驯化的微生物降解消化。而含量为100mg/L时,能抑制微生物对有机物的氧化。当水中甲醛含量为500mg/L时,生物耗氧过程全部中止,水中微生物被杀死。
3、迁移转化:甲醛由于沸点低又易溶于水,所以主要通过大气和水排放进入环境。生产甲醛的工厂其未处理的气体,当排放高度为18米时,其距工厂250-500米的大气样品中,甲醛含量均在0.035mg/m3以上。1000米远在大气中甲醛浓度在嗅阈以下。以甲醛作鞣剂生产塑料的企业周围大气中的甲醛浓度在嗅阈以下。以甲醛作鞣剂生产塑料的企业周围大气中的甲醛浓度距厂区100米内为0.012mg/m3;200米处36个样品中有15个浓度低于0.012mg/m3;400米处均低于0.012mg/m3。
工业废水中排放的甲醛含量由于行业不同有很大差别,其中浓度高的甲醛废水是生产酚醛树脂的上层焦油废水,含甲醛量高达2.5%。
4、危险特性:其蒸气与空气形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。若遇高热,容器内压增大,有开裂和爆炸的危险。
燃烧(分解)产物:一氧化碳、二氧化碳。
分子结构数据
1、摩尔折射率:6.53
2、摩尔体积(cm3/mol):43.8
3、等张比容(90.2K):82.6
4、表面张力(dyne/cm):12.6
5、偶极距(D):2.33168(1D=3.33×10-30C·m)
6、极化率(10-24cm3):2.59
计算化学数据
1.疏水参数计算参考值(XlogP):1.2
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积17.1
7.重原子数量:2
8.表面电荷:0
9.复杂度:2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.甲醛是简单的醛,通常把它归为饱和一元醛,但它又相当于二元醛。在与弱氧化剂的反应中,每摩尔HCHO多可还原出4mol的Ag或2mol的氧化亚铜,这都是乙醛还原能力的两倍,故甲醛又像二元醛。工业品通常是40%(含8%甲醇)的水溶液,俗称福尔马林。纯甲醛气体在-19℃能液化成液体。在较低温度下能与非极性溶剂(如、、氯仿、等)以任何比例混溶。其溶解度大小随温度上升而减少。甲醛能燃烧、蒸气与空气能形成爆炸性混合物。
化学性质:纯甲醛有强还原作用,特别是在碱溶液中。甲醛自身能缓慢进行缩合反应,特别容易发生聚合反应。
2.有毒,吸入甲醛蒸气会引起恶心、鼻炎、支气管炎和结膜炎等。当误服甲醛液时,应立即用水洗胃,再服用3%碳酸铵或15%醋酸铵100ml。甲醛接触皮肤,会引起灼伤,应用大量水冲洗,再用肥皂水或3%碳酸氢铵溶液洗涤。操作现场采用敞开式厂房,自然通风。空气中大容许浓度10*10-6。操作人员应穿戴防护用具。
3. 存在于烟叶、主流烟气、侧流烟气中。
4. 甲醛极易聚合,不同条件下得到不同的聚合物。
5. 将甲醛制成聚合体,便于贮存和运输。
贮存方法
1.甲醛在常温下是气态,通常以水溶液形式出现。
2.采用衬防腐材料的200L(53USgal)铁桶包装,净重200~210kg,汽车或槽车运输。甲醛水溶液不稳定,甲酸和多聚甲醛浓度随时间增加而增加,且与温度有关。低温贮存能使酸度降至低,但为防止聚合,可添加甲醇或甲基、乙基纤维素之类的稳定剂阻聚。按有毒化学品规定贮运。
3.贮存温度4℃
合成方法
甲醛属用途广泛、生产工艺简单、原料供应充足的大众化工产品,是甲醇下游产品树中的主干,世界年产量在2500万吨左右,30%左右的甲醇都用来生产甲醛。但甲醛是一种浓度较低的水溶液,从经济角度考虑不便于长距离运输,所以一般都在主消费市场附近设厂,进出口贸易也极少。工业上主要采用甲醇氧化法和天然气直接氧化法:
1、甲醇氧化法:在600~700℃下,使甲醇、空气和水通过银催化剂或铜、五氧化二矾等催化剂,直接氧化生成甲醛,甲醛用水吸收得甲醛溶液:
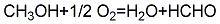
总反应是放热反应,但50~60%的甲醛是通过氧化反应生成,而其余部分是通过氢反应生成。副产物为一氧化碳和二氧化碳、甲酸甲酯及甲酸。甲醇转化率80%,收率以甲醇计为85%~90%。该法技术成熟,收率高,国内外生产厂广为采用。
2、天然气氧化法:在600~680℃下,使天然气和空气的混合物通过铁、钼等的氧化物催化剂,直接氧化生成甲醛,用水吸收得甲醛溶液:
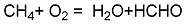
3、将甲醇蒸气在300℃时,通入铜或银的催化剂,甲醇脱氢而制得。甲醛气体吸收水含量达36%~40%,即为甲醛溶液。将市售甲醛溶液蒸馏去除杂质,并补充甲醇即为试剂甲醛溶液。
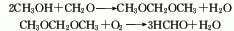
4、二甲醚氧化法 系采用合成气高压法合成甲醇副产的二甲醚为原料,以金属氧化物为催化剂氧er而成。
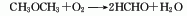
5、甲醇脱氢法 甲醇直接脱氢可得到无水甲醛,同时副产氢气。该工艺是极具吸引力的甲醛制备方法。其进展关键在于过程催化剂性能的提高。
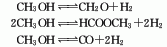
6、将气化的甲醇与经碱洗后的空气、水蒸气以1∶1.8~2.0∶0.8~1.0( 体积比)混合后,加热至115~120℃进行反应,在银催化剂作用下控制反应温度 为600~650℃,压 力0.3~0.5MPa:
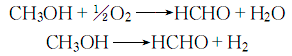
反应结束后,将反应物急冷至80~85℃,用水吸收,然后蒸馏,蒸出未反应的甲醇,釜液经阴离子交换树脂处理,所得甲醛溶液加入适量阻聚剂,搅拌混合,即得成品。
7、气体甲醛在常温下自动聚合为环状三聚甲醛。
8、甲醛很容易与氨或铵盐作用,缩合成六亚甲基四胺,所称乌洛托品。
用途
1.甲醛是一种重要的有机原料,主要用于塑料工业(如制酚醛树脂、脲醛塑料—电玉)、合成纤维(如合成维尼纶—聚乙烯醇缩甲醛)、皮革工业、医药、染料等。福尔马林具有杀菌和防腐能力,可浸制生物标本,其稀溶液(0.1—0.5%)农业上可用来浸种,给种子消毒。工业上常用催化氧化法由甲醇制取甲醛。甲醛可与银氨溶液产生银镜反应,使试管内壁上附着一薄层光亮如镜的金属银(化合态银被还原,甲醛被氧化);与新制的氢氧化铜悬浊液反应生成红色沉淀氧化亚铜。
2.甲醛的用途非常广泛,合成树脂、表面活性剂、塑料、橡胶、皮革、造纸、染料、制药、农药、照相胶片、炸药、建筑材料以及消毒、熏蒸和防腐过程中均要用到甲醛,可以说甲醛是化学工业中的多面手,但任何东西的使用都必须有个限量,有一个标准,一旦使用超越了标准和限量,就会带来不利的一面。
1)木材工业 用于生产脲醛树脂及酚醛树脂,由甲醛与尿素按一定摩尔比混合进行反应生成。
2)纺织业 服装在树酯整理的过程中都要涉及甲醛的使用。服装的面料生产,为了达到防皱、防缩、阻燃等作用,或为了保持印花、染色的耐久性,或为了改善手感,就需在助剂中添加甲醛。目前用甲醛印染助剂比较多的是纯棉纺织品,因为纯棉纺织品容易起皱,使用含甲醛的助剂能提高棉布的硬挺度。含有甲醛的纺织品,在人们穿着和使用过程中,会逐渐释出游离甲醛,通过人体呼吸道及皮肤接触引发呼吸道炎症和皮肤炎症,还会对眼睛产生刺激。甲醛能引发过敏,还可诱发癌症。厂家使用含甲醛的染色助剂,特别是一些生产厂为降低成本,使用甲醛含量极高的廉价助剂,对人体十分有害。
3)防腐溶液 甲醛是由(即甲醛亚氢钠)在60℃以上分解释放出的一种物质,它无色,有刺激气味、易溶于水。35%~40%的甲醛水溶液俗称福尔马林,具有防腐杀菌性能,可用来浸制生物标本,给种子消毒等。
甲醛具有防腐杀菌性能的原因主要是构成生物体(包括细菌)本身的蛋白质上的氨基能跟甲醛发生反应。
4)食品行业 利用甲醛的防腐性能,加入水产品等不易储存的食品中。
3.用作分析试剂,如测定铵盐。用作薄层色谱分析试剂。还用作杀菌消毒剂。用于酚醛树脂生产。生物标本浸制。
4.甲醛是第一代防腐剂。它对葡萄球菌、加单孢菌、霉菌、酵母菌和其他革兰菌均有很好的杀灭作用。但在液体洗涤剂中用甲醛做防腐剂,经济成本太高,且气味对操作人员有刺激,有毒。
5.用作化学镀铜的还原剂,用于电镀溶液的分析及电镀锌添加剂的配制等。
扩展阅读https://www.newtopchem.com/archives/1691扩展阅读https://www.bdmaee.net/dibutyl-tidichloride/扩展阅读https://www.newtopchem.com/archives/category/products/page/83扩展阅读https://www.newtopchem.com/archives/623扩展阅读https://www.bdmaee.net/wp-content/uploads/2022/08/33-4.jpg扩展阅读https://www.bdmaee.net/wp-content/uploads/2022/08/130-2.jpg扩展阅读https://www.bdmaee.net/pc-cat-nem-catalyst-n-ethylmorpholine/扩展阅读https://www.bdmaee.net/3164-85-0/扩展阅读https://www.newtopchem.com/archives/772扩展阅读https://www.newtopchem.com/archives/39847


